
作為細胞的能量供給“部門”,在此前的很多癌癥研究中,人們已經發現了線粒體的變化,但是直到最近才發現線粒體活性和細胞代謝與某些癌癥有關。只是,下游致癌信號通路即遺傳突變是如何改變線粒體活性,并最終促進腫瘤生長的機制尚不清楚。
兩個基因融合之后,會產生與融合前基因不同的功能,很多癌癥類型都存在基因融合突變,科學家也對這一現象進行了大量研究。1986年,研究人員從結腸癌組織樣品中克隆得到TPM3-NTRK1,這是最早在實體瘤中發現的融合基因之一。EML4-ALK、CD74-ROS1主要集中在非小細胞肺癌,KIF5B-RET相關突變主要集中在NSCLC和甲狀腺癌。截止至2017年5月12日,人們總共發現了超過10,861個癌癥相關的基因融合突變。科學家指出腫瘤融合基因突變可以作為癌癥治療的靶點,在診斷和預后過程中起重要的指導作用。
早在2012年,哥倫比亞大學醫學中心(CUMC)研究小組曾在Science雜志上發表了一篇文章,研究人員發現常見的具有侵襲性的原發性腦癌是由兩種基因FGFR3和TACC3融合引起的,并在97例人類膠質母細胞瘤病例中發現3例患者擁有FGFR3-TACC3基因融合。當時,人們認為這種基因融合導致的腦腫瘤僅限于一小部分患者,在美國每年影響約300名患者。
然而從那時起,其他研究人員陸續在肺癌、食管癌、乳腺癌、宮頸癌和膀胱癌等多個癌癥類型的成千上萬的患者中發現了相同的基因融合現象。CUMC研究共同負責人,癌癥遺傳學研究所神經病、病理學和細胞生物學教授Antonio Iavarone博士表示,這可能是人類癌癥中唯一最常見的基因融合。通過確定FGFR3-TACC3基因融合如何誘導和維持癌癥,可以幫助我們確定癌癥治療的新靶點,從而有效治療癌癥。

2018年1月3日,CUMC研究小組在Nature上在線發表最新文章,題為“A metabolic function of FGFR3-TACC3 gene fusions in cancer”,對基因融合進行了更加深入的探索。研究發現,FGFR3-TACC3基因融合可導致線粒體過度運動,為細胞的無限增殖提供能量,最終導致癌癥,靶向這一新發現途徑的藥物可以阻止腫瘤生長,這一結果已在人類癌細胞和腦癌小鼠模型中得到證實。
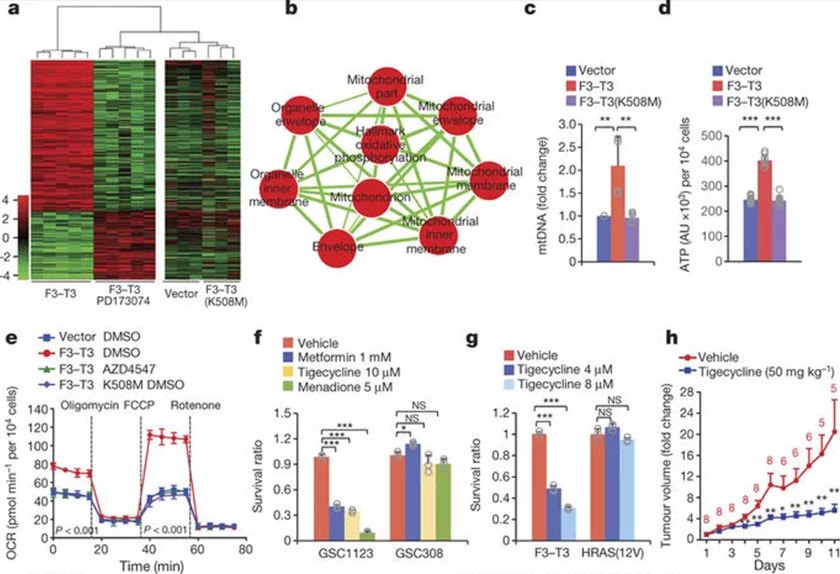
FGFR3-TACC3激活線粒體生物合成和代謝
線粒體代謝、基因融合或可成為癌癥治療新途徑
該研究中,CUMC研究人員比較了含FGFR3-TACC3與不含FGFR3-TACC3的癌細胞中成千上萬個基因的活性。分析發現,FGFR3-TACC3的融合不僅大大增加了線粒體的數量,還提高了線粒體的活性。當線粒體活動加劇時,會產生大量的能量,以供癌細胞快速分裂、生長。這也正解釋了為什么癌細胞比正常細胞以更高的速度消耗葡萄糖。
利用各種實驗技術,研究人員進一步確定FGFR3-TACC3基因融合啟動了一系列提高線粒體活性的事件。首先,基因融合激活了PIN4蛋白。激活的PIN4蛋白會移動至過氧化物酶體(過氧化物酶體含有豐富的氧化酶、過氧化物酶等),促使過氧化物酶產量增加4-5倍,釋放大量氧化劑,增加線粒體活性和能量產生。
在驗證試驗中,科學家使用線粒體抑制劑處理了含有FGFR3-TACC3的人腦癌細胞,發現這一處理阻斷了癌細胞內能量的產生,顯著減緩了腫瘤生長。在含有該基因融合物的人腦癌小鼠模型中也觀察到了相同的試驗效果。
中樞神經系統細胞中表達FGFR3-TACC3基因融合蛋白
在膠質母細胞瘤小鼠中進行測試時,研究人員對能夠幫助融合蛋白質完成其工作的FGFR3激酶,使用了相應的抑制藥物,發現患癌小鼠的存活率明顯提高。
研究共同負責人、癌癥遺傳學研究所細胞生物學教授Anna Lasorella博士表示:“癌癥研究中一直存在的關鍵問題就是癌癥基因如何激活線粒體代謝,而我們的研究提供了第一個線索,并提供了第一個直接證據表明過氧化物酶參與癌癥發生。這也為我們如何破壞癌細胞的能量供應提供了新思路。”
目前靶向基因融合的上市藥物多為激酶抑制劑。Lavarone博士表示,雖然激酶抑制劑已經在一些癌癥治療中獲得了令人鼓舞的結果。但癌細胞總是對藥物產生耐藥性,導致腫瘤復發。通過直接靶向線粒體代謝和FGFR3-TACC3基因融合就可以預防耐藥性、防止腫瘤復發。所以FGFR3-TACC3腫瘤患者可能需要雙重治療方法。目前,CUMC團隊目前正在人體癌細胞和動物模型上測試這種雙重方法。雙重抑制藥物也正在那些含有FGFR3-TACC3基因融合的復發性膠質母細胞瘤患者中進行測試。
根據這項研究的發現,研究小組也正在考慮為參與試驗的患者添加線粒體抑制劑的可能性。